Сепсис при переломах костей
 Сепсис определяют как синдром, обусловленный генерализованным течением гнойной инфекции, формирующийся под влиянием циркулирующих с кровью бактерий, токсинов, продуктов гнойно-некротического распада тканей. Одновременно важную патогенетическую роль играют измененная реактивность организма и подавление его иммунобиологической резистентности. Виды сепсиса различают в зависимости от: типа возбудителя (грамположительный, грамотрицательный, стафилококковый, колибациллярный и т. п.), клинического течения (молниеносный, острый, подострый, хронический, рецидивирующий) и характера первичного очага (раневой, ожоговый и т. д.). В настоящей статье излагаются сведения о хирургическом сепсисе, т.е. таких формах общей гнойной инфекции, которые объединены по признаку обязательного присутствия первичного гнойного очага.
Сепсис определяют как синдром, обусловленный генерализованным течением гнойной инфекции, формирующийся под влиянием циркулирующих с кровью бактерий, токсинов, продуктов гнойно-некротического распада тканей. Одновременно важную патогенетическую роль играют измененная реактивность организма и подавление его иммунобиологической резистентности. Виды сепсиса различают в зависимости от: типа возбудителя (грамположительный, грамотрицательный, стафилококковый, колибациллярный и т. п.), клинического течения (молниеносный, острый, подострый, хронический, рецидивирующий) и характера первичного очага (раневой, ожоговый и т. д.). В настоящей статье излагаются сведения о хирургическом сепсисе, т.е. таких формах общей гнойной инфекции, которые объединены по признаку обязательного присутствия первичного гнойного очага.
Входными воротами для общей инфекции в таких случаях служит нагноившаяся рана или гнойно-воспалительный процесс, локализующийся в брюшной или плевральной полости, а также в спинномозговом пространстве либо в головном мозге. Бактериемия, будучи одним из главных признаков сепсиса, регистрируется не всегда ‒ в 80‒85%. Процент положительной гемокультуры возрастает, когда кровь из вены забирают до 3 раз в сутки, приурочивая один из посевов к вечернему подъему температуры тела. В абсолютном большинстве наблюдений (90%) из крови высевают монокультуру стафилококка (60‒70%), стрептококка (2‒25%), Е. coli (6‒15%); реже идентифицируют пневмококк, синегнойную палочку, клебсиеллы, протей, анаэробы, грибы (5‒7%). В меньшем проценте наблюдений обнаруживают ассоциации патогенных микробов, вегетирующих в первичном очаге (10%). В таких наблюдениях сепсис протекает особенно тяжело.
Генерализации гнойной инфекции способствуют ранний детский или преклонный возраст, беременность, сопутствующая эндокринная патология, нарушение обмена веществ, а также другие патологические моменты, ослабляющие защитные силы организма. В этиологических и патогенетических механизмах решающая роль принадлежит, помимо микробного агента, особенностям раны или очага гнойной инфекции, а также уровню иммунобиологической защищенности организма. Важную роль микробного агента первичного очага в качестве непосредственных причин патологического процесса не в состоянии заслонить широко распространенные взгляды на сепсис как преимущественно проблему макроорганизма. В конце концов, сепсис начинается с проникновения в русло циркуляции патогенных микробов, микробных токсинов, продуктов распада тканей. Как и в механизмах развития местной гнойной инфекции, для возникновения сепсиса имеет значение количественный критерий. Если при парентеральном введении экспериментальным животным взвеси микробных тел превысить некое критическое число (105), можно вызвать общую гнойную инфекцию. Важна и качественная характеристика микробного агента, включающая его вид, биологические особенности, вирулентность. Специфические свойства микробного агента следующим образом отражаются на течении сепсиса. Грамотрицательная микрофлора (Е. coli и др.) реже приводит к образованию метастазов гнойной инфекции, но такой сепсис сопровождается более выраженной интоксикацией организма с нередкими случаями инфекционно-токсического шока. Стафилококковый сепсис, как правило, ведет к возникновению гнойных метастазов (90%), но эта закономерность не распространяется на другие виды грамположительного сепсиса (стрептококковый, пневмококковый), для всех форм которого характерно редкое развитие инфекционно-токсического (септического) шока. В зависимости от вида возбудителя пути метастазирования генерализованной гнойной инфекции варьируют: при стафилококковом сепсисе ‒ преимущественно легкие, почки, костный мозг; при стрептококковом ‒ в кожу, суставы, легкие; при пневмококковом ‒ в мозговые оболочки; при энтерококковом ‒ в эндокард; при циркуляции с кровью бактероидов ‒ в легкие, плевру, печень, мозг.
Характер первичного очага общей гнойной инфекции имеет непреходящее значение постольку, поскольку определяет, что и в каком количестве поступает в русло циркуляции. Именно здесь произрастают и приобретают вирулентные свойства патогенные микроорганизмы, количество которых становится достаточным для прорыва защитных барьеров и поступления в русло циркуляции. Принципиально говоря, сепсис может развиться при любых ранениях и нагноительных процессах. Однако его опасность, в общем, тем больше, чем значительнее масштабы повреждения, длительность и тяжесть операции, степень местного нарушения кровообращения. В соответствии с этой закономерностью к сепсису чаще ведут большие, глубокие раны, обширные скальпирования, открытые переломы крупных костей, ампутации крупных сегментов конечностей (бедро), резекция тазобедренного сустава, проникающие ранения полостей с тяжелыми внутренними разрушениями. В этих ситуациях имеют определяющее этиопатогенетическое значение большая площадь и масштабы повреждения, длительный срок, необходимый для заполнения раны грануляциями, и трудности дренировании самой раневой полости. Вероятность развития сепсиса неизмеримо возрастает при тяжелых травмах, сопровождающихся значительным некрозом и секвестрацией тканей.
Состояние иммунобиологической защищенности организма во многой зависит от глубины, характера интоксикации и действия таких дестабилизирующих факторов, как гиповолемия, анемия, гипо- и диспротеинемия, дисбаланс электролитов и др. Проникновение микробов в кровеносное русло ‒ это еще не сепсис, а простая бактериемия. При хорошем состоянии естественных защитных барьеров организм за короткий срок освобождается от проникших в кровь микробов. Глубокое угнетение механизмов иммунобиологической защиты лежит в основе хорошо известного клиницистам факта, когда небольшой очаг гнойного воспаления, например фурункул, панариций, за несколько дней приводит к возникновению генерализованной формы инфекции, сопровождающейся множественным метастазированием во внутренние органы и смертельным исходом. С другой стороны, обширные и глубокие раны далеко не всегда сопровождаются прорывом иммунитета и возникновением сепсиса. Вероятность развития сепсиса во многом определяется соотношением сил микро- и макроорганизма.
Известны три основных источника интоксикации при сепсисе: поступление в кровь продуктов жизнедеятельности или распада микробов (бактериальные токсины), ферментов и токсических субстанций нарушенного метаболизма. В основе септической гиперферментемии лежат повышение протеолитической активности крови, появление в русле циркуляции свободных кининов, избыточное содержание простагландинов. Вследствие массивного разрушения лейкоцитов, лизосомы которых особенно богаты протеазами, резко повышается их уровень в крови. Одновременно увеличивается содержание в крови «средних молекул» и катионных белков, также играющих важную роль в механизмах интоксикации. Повышение уровня протеолитических ферментов способствует формированию очагов некрозов во внутренних органах, а последующее инфицирование превращает их во вторичные гнойно-метастатические очаги. Именно под влиянием возрастающей активности протеолитических ферментов развиваются вторичный фибринолиз и синдром ДВС.
Глубокая интоксикация организма подавляет основные реакции противомикробной защиты, такие как хемотаксис лейкоцитов, фагоцитоз, бактерицидная активность лейкоцитов и сыворотки крови. Массивное поступление в кровь бактериальных токсинов, продуктов распада тканей способствует сенсибилизации организма и нарушению его реактивности.
На фоне сепсиса нарушаются все виды обмена. Стимуляция катаболизма и угнетение белковообразовательной функции печени являются причиной развивающейся гипопротеинемии, нарушения азотистого баланса, снижения иммунобиологической защищенности организма, угнетения репаративных процессов. Водно-электролитные расстройства проявляются в форме снижения содержания в клетках калия и повышения натрия и воды; в крови, напротив, возрастает содержание калия и понижается уровень натрия. Концентрация сахара в крови также постоянно повышена. Одновременно отмечаются пониженная толерантность к глюкозе и возрастающая резистентность к инсулину.
Сепсис может развиться в различные сроки после открытого повреждения или возникновения очага гнойного воспаления ‒ от нескольких часов до многих суток и даже недель. Варианты его начала и клинического течения определяет соотношение тех же патогенетических факторов, что и при развитии хирургической инфекции: число и патогенные свойства микробного агента, характер первичного очага, состояние иммунобиологической защищенности и реактивности организма. Эти же факторы определяют и два клинических варианта сепсиса ‒ септицемию (общая гнойная инфекция без метастазов) и септикопиемию (метастазы вторичной гнойной инфекции). Сепсис может развиться в самом начале или на высоте общей гнойной инфекции, а иногда в форме внезапно наступающего инфекционно-токсического (септического) шока. При молниеносном и остром течении клиническая симптоматика сепсиса развертывается на протяжении часов и дней, а при подостром, хроническом течении ‒ на протяжении недель и месяцев.
Начальные симптомы общей гнойной инфекции порой трудно отличить от тяжелых проявлений местных форм раневой инфекции. Нелегко различить по внешним клиническим проявлениям септицемию и септикопиемию, если только последняя не проявляется яркими симптомами нарушения функций головного мозга, сердца, легких, что наблюдается достаточно редко. В начальной стадии генерализованной гнойной инфекции еще не потеряна зависимость общих симптомов от состояния и степени дренирования местного очага. Эта связь выражается в том, что вскрытие гнойной полости, затека, флегмоны или ампутация сегмента конечности вместе с первичным очагом гнойно-септической инфекции довольно быстро приводят к исчезновению общих симптомов интоксикации. В дальнейшем эта связь ослабевает, однако ее полной утраты чаще всего не наступает вплоть до развития финальной стадии сепсиса. На высоте сепсиса общее состояние больного катастрофически ухудшается, возникают глубокие изменения во внутренней среде организма, бросается в глаза несоответствие между тяжелыми общими расстройствами, в частности кровообращения, дыхания, и относительно скудными местными изменениями в ране. Больные жалуются на головную боль, раздражительность, бессонницу, возможна временная эйфория. При нарастании интоксикации постепенно прогрессирует угнетение нервной системы, помрачение и полная утрата сознания. Исчезает аппетит, возникают изнуряющие тошнота, рвота, понос. В раннем периоде присоединяется плевропневмония. При объективном исследовании констатируют увеличение печени и селезенки, отеки, олигурию. Весьма характерна температурная кривая: либо постоянная высокая лихорадка, либо гектические размахи температуры с ознобами и проливным потом. Масса тела быстро уменьшается, развивается алиментарное истощение. Вследствие глубокой интоксикации организма очень частый пульс определяют даже в период кратковременного понижения температуры. Наполнение пульса уменьшается параллельно с нарастающей гипотензией, понижением уровня ЦВД. Вследствие сосудистых и трофических нарушений развиваются отеки, тромбофлебиты и пролежни. В крови нарастают анемия, лейкоцитоз, выраженный нейтрофильный сдвиг в лейкоцитарной формуле, лимфопения. Иногда количество лейкоцитов снижается в результате глубокой интоксикации и чрезмерного угнетения реактивности организма. Резко возрастают показатели фибриногена, С-реактивного белка, сиаловых кислот, нарушается соотношение иммуноглобулинов, возможно развитие синдрома ДВС и тромбогеморрагических осложнений. Непосредственными источниками кровотечений служат эрозии крупных сосудов, гнойное расплавление тромбов и пролежни, образующиеся в местах нахождения дренажей. Возможна тромбоэмболия крупной артерии, приводящая к инфаркту внутренних органов и омертвению целой конечности. Сопутствующий эндокардит относительно чаще поражает двустворчатый клапан. Токсические изменения в почках проявляются снижением плотности мочи, появлением в осадке форменных элементов и белка. Развивающийся токсический гепатит вызывает желтушное окрашивание склер, кожи и слизистых оболочек. Метастазирование гнойной инфекции придает специфический оттенок дальнейшему лечению сепсиса (септическая плевропневмония, эндокардит, абсцесс головного мозга). Однако гораздо чаще процесс метастазирования протекает незаметно. Вскрытие гнойного очага ослабляет проявление общих симптомов, понижает температуру тела, но при возникновении новых очагов вторичной гнойной инфекции симптоматика опять нарастает.
Для септической раны характерны сухость, грязновато-серый цвет тканей, бледные, отечные, кровоточивые грануляции, гнилостный запах, скудное отделяемое. Идентификация возбудителя из крови и раны необходима для подтверждения диагноза и назначения рациональной антибиотикотерапии. Для сепсиса характерна триада признаков, имеющая практическое значение в диагностике: гектические размахи температуры, положительная гемокультура при бактериологических посевах крови, выявление метастатических гнойных очагов, первым из которых чаще всего бывает плевропневмония.
Учитывая многообразие и тяжесть патологических расстройств при сепсисе, его эффективное лечение может быть только комплексным. Необходимы хирургическая санация всех гнойных очагов, осуществляемая в неотложном порядке, активная антибиотикотерапия, своевременная и полная коррекция анемии, гипопротеинемии и водно-электролитных расстройств, поддержание работы сердца и функции внутренних органов. Следует четко представлять, что без своевременного выявления и неотложного хирургического лечения первичных и вторичных гнойно-инфекционных очагов все остальное лечение сепсиса окажется бесперспективным. Одновременно важную роль играют общие мероприятия, направленные на повышение иммунобиологической резистентности организма, необходимые для успешной борьбы с инфекционным агентом. Прежде всего для больного следует создать самые благоприятные санитарно-гигиенические условия и наладить питание пищей, богатой белками, витаминами, энергетическими веществами. С особой тщательностью проводят систематические ингаляции, массаж, стимуляцию кашлевой активности и другие мероприятия из комплекса интенсивной терапии. Они направлены на предупреждение легочных осложнений и образования пролежней. Септических больных следует изолировать в отдельные палаты. Из антибиотиков избирают современные высокоактивные препараты бактерицидного действия. До получения ответа на чувствительность микрофлоры к антибиотикам назначают пенициллин (по 5 млн Ед через 4 ч) в сочетании с ампициллином (0,5 г 2 раза в сутки). В дальнейшем, в зависимости от чувствительности выделенного возбудителя, применяют один из современных аминогликозидов (гентамицин, тобрамицин, амикацин) или один из цефалоспоринов либо клиндамицин. Одновременно необходимо начать курс введения гипериммунной плазмы, γ-глобулина (ежедневно в течение 5‒6 дней). После завершения курса пассивной иммунизации приступают к выработке активного иммунитета при помощи стафилококкового либо иного анатоксина (по схеме). Остро необходимы переливания свежегепаринизированной крови, альбумина, плазмы, с помощью которых не просто достигают нормализации ОЦК, коллоидно-осмотического градиента и гомеостаза в целом, но и стимулируют защитный потенциал организма. Также необходима ежедневная инфузия кристаллических аминокислот, аскорбиновой кислоты, других витаминов, препаратов с выраженными реологическими свойствами. Количественный и качественный состав инфузионной терапии уточняют в ходе интенсивного наблюдения за больным, повторных определений ОЦК, ионограммы, концентрации белка. Для удовлетворения энергетических нужд (не менее: 10,5 МДж/сут) применяют концентрированные растворы глюкозы, жировые эмульсии. Ежедневно в состав инфузионной терапии должны включаться препараты, обладающие дезинтоксикационными свойствами (гемодез). Одновременно дезинтоксикации организма способствует применение метода форсированного диуреза (лазикс, эуфиллин). Целесообразно назначение ингибиторов протеолитических ферментов (контрикал, гордокс, трасилол, цалол). В комплексной интенсивной терапии хирургического сепсиса хорошо зарекомендовала себя ГБО, благоприятно влияющая на состояние обменных процессов, уменьшающая функциональное напряжение важнейших систем организма, усиливающая бактерицидное действие антибиотиков, а в ряде случаев непосредственно воздействующая на возбудителя.
Общие исходы лечения сепсиса остаются неблагоприятными, а летальность достигает 25‒30%. Когда развитие сепсиса происходит после брюшнополостных вмешательств, число смертельных исходов особенно велико (90%). Непосредственными причинами смерти служат инфекционно-токсический (септический) шок, плевропневмония, гнойный миокардит, ОПН, эмболия легочной артерии.
Источник
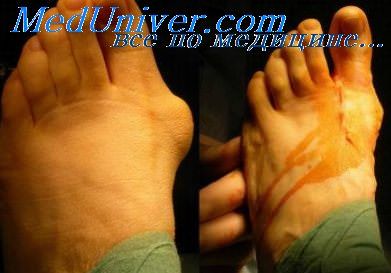
Инфицирование зоны перелома. Опасность инфицирования размазженных ранОпасность инфицирования зоны перелома, естественно, наиболее велика при открытых переломах костей конечностей. Однако нельзя не учитывать ее при закрытых переломах, особенно в тех случаях, когда речь идет о показаниях к оперативному лечению. В этом отношении особенную настороженность следует проявлять при закрытых переломах, возникших в результате дорожно-транспортных происшествий и сопровождающихся сдавлением мягких тканей без повреждения кожных покровов или с крайне незначительным по размерам повреждением кожи над уровнем перелома. Как показали наши наблюдения, подобные повреждения конечностей возникают при перекатывании колеса автомобиля через конечность или при сдавлении конечности между автомобилем и каким-либо массивным неподвижным предметом. Приведем характерное в этом отношении собственное наблюдение. 22.V 1974 г. на гражданина С, 33 лет, питавшегося корректировать действия совершенно неопытного водителя, совершил наезд автомобиль «Москвич-401». Нога С. после удара задним бампером на какое-то время оказалась прижатой к стенке дома. Произошел поперечный перелом обеих костей голени с выколом нескольких мелких осколков и образованием небольшой (0,5 см в диаметре) раны. При пальпировании области перелома определена нечеткая флюктуация под кожей и в глубине задней группы мышц голени. Концы фрагментов большеберцовой кости смещены по ширине на полный поперечник и по длине — на 4—5 см. Первичная хирургическая обработка раны в подобных случаях бывает очень сложной, так как не ясен объем повреждения мягких тканей и практически неразличимы границы жизнеспособных тканей. Поэтому больному С. операцию первичной хирургической обработки раны голени не производили, а после туалета раны в мягкие ткани в области перелома ввели раствор антибиотиков. Наложена система постоянного скелетного вытяжения. Репозиция фрагментов достигнута спустя две недели. Но на месте ушиба и сдавления голени развился некроз мягких тканей. Лечение этого осложнения продолжалось более месяца, в течение которого почти ежедневно производили перевязки циркулярной раневой поверхности На контрольной рентгенограмме через месяц после перелома между концами фрагментов большеберцовой кости был виден диастаз в 4 мм. Изменения в системе вытяжения на положении фрагментов не сказывались. От предложенной операции внеочагового компрессионного остеосинтеза С категорически отказывался в течение трех месяцев (это время поврежденная конечность была иммобилизована гипсовой повязкой и лечение осуществляли амбулаторно). После согласия больного на операцию произведено наложение компрессионно-дистракционного аппарата конструкции Г. А. Илизарова. Достигнута компрессия концов фрагментов при абсолютной неподвижности, и через несколько дней больной выписан для амбулаторного лечения. Простудившись под холодным осенним дождем, С. начал самостоятельное лечение по поводу простудного заболевания, на фоне которого через несколько дней появились боли и гиперемия в области бывшего перелома. С высокой температурой С. третий раз поступает в клинику.
Несмотря на энергичное применение антибиотиков, состояние больного прогрессивно ухудшалось, развилась двусторонняя абсцедирующая пневмония. Вскрыты гнойные затеки на голени. Поскольку кольца аппарата Илизарова располагались очень близко одно к другому, не было возможности делать перевязки на голени, аппарат был снят и вместо него наложена окончатая гипсовая повязка. Лечение больного продолжено в отделе легочной хирургии Харьковского научно-исследовательского института общей и неотложной хирургии. Сделана чрез кожная трахеостомия и начато вливание растворов антибиотиков во вставленную в трахею трубочку. Проведены инфузионная и антибактериальная терапия, причем антибактериальная терапия контролировалась чувствительностью микрофлоры к антибиотикам. В дальнейшем наступило выздоровление больного и восстановление функции конечности. Данное наблюдение свидетельствует о том, что в современных условиях антибиотики далеко не всесильны. Мы полностью разделяем общепризнанное мнение, что при острой открытой травме основная роль по-прежнему принадлежит тщательной первичной хирургической обработке раны. Антибиотики могут задержать рост бактерий и развитие инфекции на случай вынужденной отсрочки хирургического вмешательства (А. В. Каплани О. Н. Маркова, 1970; А. В. Вишневский, М. И. Шрайбер, 1975; В. М. Мельникова, 1975). — Также рекомендуем «Посттравматический сепсис. Нагноение забрюшинных гематом» Оглавление темы «Лечение дорожной травмы»: |
Источник